中 4·美 2 등 全세계 8개 백신 임상 진입… 美기업 모더나 개발 주도
韓 SK바이오사이언스도 자체 발굴 후보물질 평가 … 9월께 임상 목표
전문가 "안전성 간과땐 되레 병 더 심각해져… 더 큰 문제 야기할수도"
韓 SK바이오사이언스도 자체 발굴 후보물질 평가 … 9월께 임상 목표
전문가 "안전성 간과땐 되레 병 더 심각해져… 더 큰 문제 야기할수도"

SK바이오사이언스 제공
코로나19 백신 개발에 있어 속도전도 중요하지만 안전성 문제가 묻혀선 안 된다는 지적이 나오고 있다. 현재 코로나19 확산으로 인해 전세계가 장기간 경제·사회적 위기에 빠진 상태다. 감염자가 발생해도 국지적 확산에 그칠 수 있도록 하루빨리 백신이 나와줘야 하는 상황이다. 25일 바이오업계와 외신에 따르면, 코로나19 백신 개발부문에는 미국 기업 모더나가 앞서가고 있다.
국내 다수 기업들도 개발에 뛰어들었지만, 아직 임상단계에 진입한 곳은 없다.
모더나는 미국 국립알레르기·감염병연구소(NIAID)과 협업해 백신을 개발하고 있다. 모더나와 NIAID의 연구자들은 지난 1월 코로나19 바이러스의 유전자 정보를 파악해 낸 데 이어, 2월에는 임상 실험을 위해 제조한 백신을 NIAID 실험실에 전달했다. 이후 지난 3월 임상 1상에 진입한는 등 코로나19 백신개발을 주도하고 있다. 최근에는 외신 보도를 통해, 1상 임상실험에서 유의미한 결과가 도출됐다고 전해지기도 했다.
모더나가 개발 중인 백신 후보는 바이러스의 유전 정보를 조작한 메신저 RNA(mRNA)를 이용한 것이다. 코로나19 바이러스가 인체 내에 침투할 때 사용하는 '스파이크 단백질'과 유사한 단백질을 생산하도록 코로나 바이러스의 mRNA를 조작하는 원리다. 이렇게 조작된 mRNA가 인체에 주입되면, 바이러스의 단백질 조각을 생산해 내고, 우리 몸이 이를 항원으로 인식하게 된다.
특히 미국에서는 식품의약국(FDA)의 독성시험 면제 조치에 힘입어 임상이 빠르게 이뤄지고 있다.
송만기 국제백신연구소 사무차장은 최근 진행된 '바이오코리아 2020 - 코로나19 특별세션'에서 "FDA는 RNA, DNA 등 플랫폼을 이용해 다른 바이러스들에 대한 임상시험을 여러번 거쳐 안전성이 입증된 경우에 한해 독성시험을 면제해주고 있다"며 "모더나가 임상시험에 진입한지 한달 후에는 이노비오의 DNA 백신이 미국에서 임상 1상에 들어갔고, 큐어벡 RNA 백신, 퀸즈랜드 대학의 분자 클램프 기술에 대한 코로나19 백신 개발 지원이 이뤄졌다"고 설명했다. 이어 "어떤 후보 백신이 개발에 성공할지, 어떤 플랫폼이 안전하면서도 효과적이며 대량생산이 가능할지는 실제로 경험을 해봐야만 알 수 있는 것이기 때문에 다양한 플랫폼 기술로 백신 개발을 지원하는 것"이라고 덧붙였다.
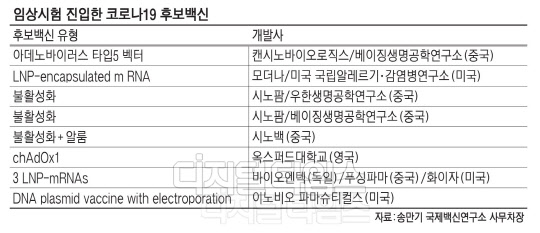
5월11일 기준 세계보건기구(WHO) 자료에 따르면, 현재 전세계 8개 백신이 임상에 진입한 상태다. 중국에서 4개, 미국에서 2개, 독일과 영국에서 각각 1개씩 코로나19 임상에 진입하는 성과를 냈다.
한국에서도 SK바이오사이언스, 제넥신 컨소시엄(제넥신, 바이넥스, 국제백신연구소, 제넨바이오, 카이스트, 포스텍 등), 스마젠, 진원생명과학, 한국화학연구원 등 최소 8개 연구소·기업에서 백신을 개발 중인 것으로 알려졌으나, 임상에 진입한 사례는 아직 나오지 않았다. 현재 국내에서는 제넥신 컨소시엄에서 개발 중인 코로나19 DNA 백신이 가장 앞서있다. 제넥신 컨소시엄은 코로나19 백신 후보물질 'GX-19'을 도출해 원숭이를 대상으로 동물실험을 진행했고, 바이넥스에서 임상 시료 생산을 완료했다. 이달 중 식약처에 임상시험 계획 신청서를 제출할 계획이다. 예정되로 절차가 진행되면 내달 중 임상시험을 개시할 수 있을 전망이다.
SK바이오사이언스는 자체 발굴한 코로나19 백신 후보물질에 대한 안전성을 평가하고 있다. 오는 9월 임상시험 진입을 목표로 하고 있다. 이 회사는 빌&멜린다 게이츠 재단으로부터 코로나19 백신 개발을 위한 자금을 지원받은 상태다.
이처럼 국내 기업들도 코로나19 백신 개발에 뛰어들었지만, 국내에서는 일반적으로 6개월이 소요되는 독성시험에 대한 면제가 이뤄지지 않고 있는 상화이라, 다른 나라보다 개발 속도에서 뒤쳐질 수 밖에 없다.
전문가들은 백신 개발 '속도전'에 정작 중요한 백신의 안전성 문제가 묻혀서는 안 된다고 지적하고 있다. 송 사무차장은 "영아에게 큰 문제가 되는 RSV바이러스에 대한 백신 개발이 1960년대에 많이 이뤄졌는데, 그 중 포르말린으로 불활성화된 백신도 임상이 이뤄졌었다"며 "그런데 이 백신을 맞은 그룹에서 80%가 나중에 RSV가 결렸을 때 오히려 병이 심각해져 입원을 했고, 그 중 2명의 아이가 사망했다"고 지적했다. 이어 송 사무차장은 "백신이 오히려 사람들을 위험에 빠뜨린 최근의 사례로는 댕기 백신이 있다"며 "백신을 접종한 그룹에서 나중에 몸에 바이러스가 들어왔을 때, 더 심각한 문제가 일어나는가 하면, 필리핀에서는 백신 때문에 사망했다는 보고까지 나와 사용이 금지됐다"고 덧붙였다. 백신의 조속한 개발 만큼, 안전성 검증 역시 중요하며 이를 간과할 경우, 바이러스에 대항하기 위해 개발된 백신이 인류를 살리는 게 아니라, 오히려 더 큰 문제를 야기할 수도 있다는 게 전문가들의 경고다.
김수연기자 newsnews@dt.co.kr
임상시험 진입한 코로나19 후보백신 | |
후보백신 유형 | 개발사 |
아데노바이러스 타입5 벡터 | 캔시노바이오로직스/베이징생명공학연구소(중국) |
LNP-encapsulated m RNA | 모더나/미국 국립알레르기·감염병연구소(미국) |
불활성화 | 시노팜/우한생명공학연구소(중국) |
불활성화 | 시노팜/베이징생명공학연구소(중국) |
불활성화 + 알룸 | 시노백(중국) |
chAdOx1 | 옥스퍼드대학교(영국) |
3 LNP-mRNAs | 바이오엔텍(독일)/푸싱파마(중국)/화이자(미국) |
DNA plasmid vaccine with electroporation | 이노비오 파마슈티컬스(미국) |
자료:송만기 국제백신연구소 사무차장 | |
[ 저작권자 ⓒ디지털타임스, 무단 전재 및 재배포 금지 ]